由於疾病的複雜和多樣性,抗擊胰腺癌仍然是一個令人眼花ag亂的挑戰。科學家已經尋求更好的方法來有效地將治療基因引入癌細胞。一種有希望的方法涉及使用病毒將這些基因運輸到細胞。但是,很難找到可以在所有不同亞型的胰腺導管腺癌(PDAC)中不斷傳遞基因的合適病毒。這是仙台病毒表現出非凡諾言的地方,提供了一種克服這些挑戰的強大而有效的方法。
俄勒岡大學健康與科學大學的研究人員由舊作家Jungsun Kim博士和她的同事(包括第一作者Dmytro Grygoryev博士)領導,已經證明,Sendai病毒(SEV)是PDAC細胞中基因分佈的強大而有效的載體。他們的發現發表在同齡人Heliyon修訂的雜誌上,表明,仙台病毒在轉導效率方面超越了其他人,使其成為PDAC基因治療的有前途的工具。
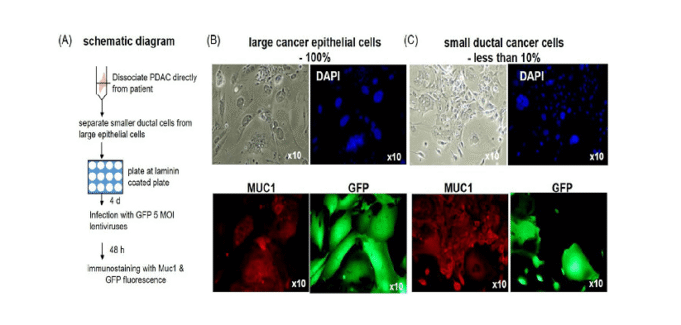
PDAC的生存率較低,其五年生存水平在所有癌症中均較低。這部分是由於缺乏早期症狀和可以緩解早期診斷的非質標記。了解PDAC分子機制並確定新的治療目標對於改善患者的結果至關重要。 PDAC可以分為兩個主要的“經典”和基礎轉錄本亞型,即鱗狀或腸系膜”,並確定高腫瘤內和內部異質性。因此,持續分配轉基因的轉基因很重要。
該小組注意到慢病毒將一些PDAC亞型或正常細胞轉換為來自患者的培養物。該觀察結果促使研究人員比較了不同媒介的轉導的效率,包括正常胰腺導管細胞和來自患者的PDAC的載體載體載體載體,病毒病毒(VSV-G)。結果不斷通過各種PDAC亞型偏愛仙台病毒載體,無論細胞的類型如何,都表明了其強烈的性能。 Kim博士說:“無論PDAC亞型如何,仙台病毒載體提供了最強的基因分佈效率。這使其成為基於基因的治療策略的寶貴工具。”
該研究還強調了其他病毒載體的限制。例如,根據PDAC細胞的類型,慢病毒載體顯示出可變的轉導效率,在經典PDAC亞型細胞中的性能較差。同樣,AAV矢量雖然廣泛使用,但具有一些缺陷,包括需要高劑量和有限的基因組包裝能力。相反,仙台病毒是一種RNA病毒,在細胞質中重複出現,而不整合到宿主基因組中,從而避免了基因組的可能斷裂。
仙台病毒提供了一種非整合基因分佈的方法,這對於維持宿主細胞的遺傳完整性很有用。仙台病毒的另一個重要優勢是他能夠長時間延長高度分裂細胞中的轉基因表達,最多五個通道。這對於可持續基因表達至關重要的長期研究和治療應用特別有用。 “我們的發現表明,仙台病毒是一種有效的基於RNA的基因分佈載體,能夠在PDAC和正常胰腺通道細胞中長期跨性別表達。KIM。
這項研究的含義很棒,尤其是針對基於基因的胰腺癌療法的發展。仙台病毒轉導的高效率也使其適用於基因組的廣泛遺傳表現,這需要低多數的細胞感染。此外,仙台病毒的安全性(永遠不會與人類疾病相關)進一步增加了其細胞療法的潛力,例如體內轉換或胰腺疾病中直接重編程。
儘管結果取得了令人鼓舞,但研究人員承認需要進一步研究以確定體內毒性和效率的程度,尤其是在壁模模型中,由於其在囓齒動物中的致病性,無法使用仙台病毒。未來的研究還將探索仙台病毒在三維培養環境中的實施,例如器官培養物,以更好地模仿腫瘤的微環境。
總之,Kim博士及其同事的研究創建了仙台病毒,作為源自人類患者的PDAC的出色基因分佈載體,為基於基因的治療干預提供了新的途徑。這項工作確立了未來研究的階段,以促進臨床和臨床前環境中的仙台病毒技能,從而有可能改變胰腺癌治療的景觀。
日記
Grygoryev D.等。 “仙台病毒在人類胰腺癌細胞中的基因分佈方面具有強大穩定。” Heliyon,2024。 Doi: https://doi.org/10.1016/j.heliyon.2024.e27221
作者周圍
Jungsun Kim長期的可持續興趣是基於癌症發展和進步的可逆調節機制,其最終目的是在早期癌症治療中實施發現。為此,它證明了PDAC重編程模型的證據原理,該原理為前所未有的實驗訪問人類胰腺癌的實驗訪問提供了人類細胞模型。使用該系統,它檢測到一個調節網絡和一個分泌或釋放的蛋白質,可以區分胰腺癌的早期研究I期以及健康對照中PDAC的所有階段。經過這些研究,Kim博士的研究將重點放在以下領域。 “癌症重編程和編程”(1)癌症癌症癌症癌症癌症的調節網絡在癌症癌症(3)調節網絡中引起的癌症重編程因子和障礙的作用(3)從前體向癌症過渡。它花了學士學位和博士學位。在Il-Yup Chung博士的指導下,韓國Hanyang University的生物化學博士學位,並在賓夕法尼亞大學的肯尼斯·扎雷特(Kenneth Zaret)博士的指導下完成了博士後研究。