UREG是一種分子伴侶,可在Urechase的激活中起作用,UREHASE是一種鎳依賴性酶,許多致病性細菌和真菌都需要感染其宿主。 UREG多任務也充當GTPase酶,與其他伴侶合作,從GTP水解引導能量,從而使離子鎳對尿素激活至關重要,從而在細胞生態系統和金屬穩態的路徑中起關鍵作用。
In a historical study, Dr. Elisabetta Mileo from the BIP Laboratory (Aix Marseille and CNRS University) and Professor Barbara Zambelli from the Department of Pharmacy and Biotechnology (University of Bologna), along with Professor Valérie Belle, Professor Bruno Guigliarelli, Dr. Emien Etienne, Dr. Guilleume, Huguenno Belle, Ketsy, Ketsy, Dr. EMienne. Tamburini和Aix Marseille University的Annalisa Pierro發現了活細胞內GTPase Ureg蛋白的動態行為。這代表了我們在自然棲息地中蛋白質功能的意義上的巨大跳躍。他們的研究發表在《著名的雜誌》中,闡明了細菌中尿素酶所必需的UREG蛋白如何在其生理競爭中表現出極大的靈活性,這對於其酶活性可能是必不可少的。
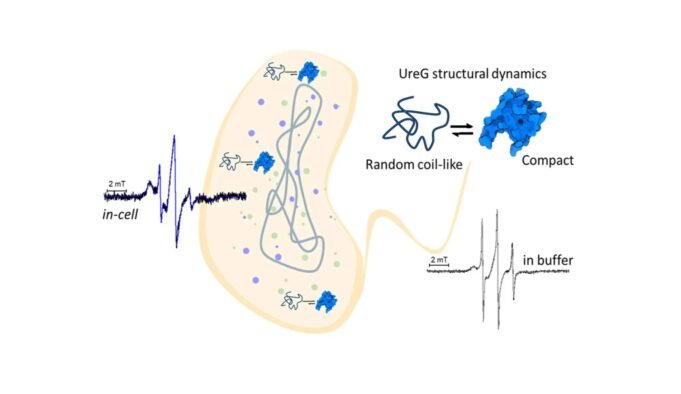
以前,通過體外研究很好地證明了URER作為伴侶在激活鎳依賴性酶中的作用,這證明了該酶在溶液中的柔性行為。該數據通過設置從位點引導的旋轉以及電子(SDSL-EPR)的順磁共振光譜的旋轉來直接觀察活細胞內URER的行為,從而推動了前進的理解。
Zambselli博士強調了這項研究的重要性,他說:“發現表明UGG擁有多樣的結構景觀 在細胞中存在於兩個領先人群的合格集合中,它們表現出隨機線圈或緊湊的特性。這些知識肯定了UREG的天然無序性質的生理重要性,並暗示了該特定酶的蛋白質靈活性的作用,也許與對金屬離子分佈的廣泛蛋白質相互作用的調節有關。 “
研究人員使用創新技術在細胞環境中輸入UREG蛋白行為。 “在細胞中 首先進行了EPR實驗,將重組表達產生的興趣蛋白標記,然後將其分佈在細胞中。
這項研究不僅強調了UREG蛋白的內部障礙和靈活性,而且還標誌著在其天然細胞環境中蛋白質研究中的顯著進度。 Mileo博士補充說:“採用基於氮氧化物的旋轉標籤可以在室溫下分析EPR分析,與所研究的細胞壽命相兼容。”利用先進的SDSL-EPR光譜,研究團隊為UEG景觀提供了寶貴的知識,為未來的努力奠定了基礎知識,旨在發現活細胞中蛋白質功能的複雜機制。這項研究不僅加深了我們對蛋白質動力學的含義,而且還為開發有針對性的療法和生物技術應用開發了用於檢測新藥和抗微生物分子的生物技術應用。
日記
Annalisa Pierro等人,“ SDSL-EPR在UREG GTPase的細胞景觀中進行的研究”,Iscience,2023年。
doi: https://doi.org/10.1016/j.isci.2023.107855。
作者周圍
芭芭拉·贊貝利(Barbara Zambelli) – 2021年的副教授,自2008年以來以前在Unibo的助理教授。她的研究活動旨在了解分子和結構水平,以了解, 金屬領導的蛋白質相互作用 在生物系統中,它負責調節對生命重要的代謝過程。特別是,其主要研究行涉及的細胞代謝 鎳 及其對 人類健康有可能的醫療和藥物應用。

Elisabetta Mileo 他是法國馬賽(Marseille)的“BioénergétiqueetingénieriedesProtéines”(Bip)的CNRS研究員。它是一名化學家,也是一位經驗豐富的光譜學家,在結構生物學中的氮氧化物自由基作為旋轉標籤的合成和使用中。研究活動E. Mileo主要集中於研究蛋白質的結構動力學,尤其是在伴侶和其他柔性蛋白上,目的是獲取有關蛋白質動力學如何影響蛋白質功能的信息。其工作的獨創性在於以下事實:SDSL-EPR的蛋白質研究直接在細胞內攜帶(在細胞中 EPR),在生理條件下。它的研究還旨在開發新的工具和新的旋轉標籤,以遵循從EPR到活細胞的“作用”蛋白質。