一種侵略性的CD30+ T細胞淋巴瘤,大型那內層細胞淋巴瘤(ALCL)由於其複雜的遺傳鹼和對常規療法的耐藥性,在腫瘤學上提出了令人恐懼的挑戰。由托馬斯(Thomas)教授領導的研究人員研究了達納 – 法伯癌症研究所(Dana-Farber Cancer Institute)和波士頓兒童醫院(Boston Children Hospital),已經闡明了ALCL病理學的基本機制,為靶療法提供了一種可能的方法。他們在細胞報告醫學上發表的發現表明,作為一種主要信號蛋白STAT3,與基本轉錄調節劑集成在一起,以維持ALCL中的惡性狀態。
研究團隊,包括Nicole Prutsch博士,Brian Abraham博士,Mark Zimmerman博士及其同事們前往本研究,以了解STAT3在ALCL中的確切作用。他們的合作努力通過了包括兒童研究醫院聖裘德,劍橋大學和維也納醫科大學以及達納·法伯癌症研究所的機構。該研究發表在同事修訂的《細胞細胞報告》雜誌上。
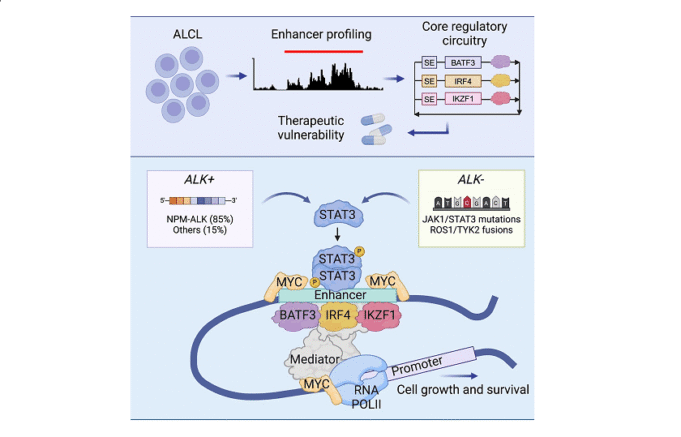
ALCL通常是由激活鹼性酪氨酸或其他導致JAK-STAT信號通路連續激活的染色體恢復驅動的。 Look教授和他的團隊發現,在ALCL細胞中,作用的STAT3與主要轉錄的其他因素 – BATF3,IRF4和IKZF1 – 形成了基本的調節迴路(CRC),以促進癌細胞存活和擴散。 Zimmerman博士說:“我們的研究表明,ALCL細胞在很大程度上取決於監管轉錄的一小部分基本因素。這些成癮的目的為治療干預提供了新的方法。”
該團隊使用染色質免疫沉澱序列(CHIP-SEQ)設計ALCL細胞中的升級區域,鑑定了一組與基因相關的主管,例如BATF3,IRF4和IKZF1。這些區域對H3K27AC高度富集,這是主動升級組蛋白的修飾的特徵,強調了這些基因編碼的轉錄因子在惡性表型的擴展關鍵基因程序的高表達中的作用。此外,廣泛的基因組佔用分析表明,STAT3在激活ALK激酶後與這些CRC轉錄因子合作在超級改進中,提供了致癌基因的可持續表達。
該研究強調,儘管缺乏指導其表達的超級改善,但Stat3儘管不符合CRC組件的典型標準,但作為負責信號的因素起關鍵作用。一旦通過激酶酪氨酸的信號傳導激活,STAT3與CRC同時起作用,以調整MYC的表達,這是一種眾所周知的癌基因。亞伯拉罕博士指出:“我們的發現表明,STAT3與CRC轉錄因子一起指導ALCL中的致癌基因表達程序。”
Food教授強調了他們的研究的長期重要性,他說:“我的實驗室發現了ALK基因和1994年NPM Union Gene,該基因提供了激活了STAT3信號傳導的激活的激酶,如30年後的當前信中報導的那樣,在ALCLS的大部分(2; Chormamal)中提供了重大轉換機制。
在功能分析中,研究人員表明,CRC的任何單一成分的分解都顯著損害了ALCL細胞的生長和可持續性。特別是,IKZF1的藥理降解導致細胞生長的降低,強調了其在調節CRC中的重要作用,這對於ALCL細胞的擴散和存活至關重要。此外,該小組表明,STAT3抑製劑(例如STAT3-IN-3和Statstic)有效地降低了ALCL細胞的耐用性,並將其與IKZF1降解器結合起來,從而產生了更明顯的抗腫瘤效應。
該研究的關鍵陳述之一是STAT3和MYC之間的相互作用。使用CHIP-SEQ,研究人員發現STAT3與MYC基因的超級改進調節區有關,MYC基因產生了高水平的MYC蛋白,然後與CRC轉錄因子合作以保持高水平的MYC表達。這種相互作用強調了ALCL中STAT3靶標的治療潛力,尤其是在抗ALK抑製劑的情況下。 “證明STAT3激活對於表達MYC和ALCL細胞的存活是必要且足夠的,我們為靶標STAT3療法的發展提供了強有力的理由,” Look教授補充說。
總之,這項研究闡明了持有ALCL的複雜調節網絡,並將STAT3識別為致癌過程中的關鍵。研究團隊的合作努力為旨在在ALCL互連的轉錄依賴性的新治療策略鋪平了道路。正如教授所說:“我們的工作為ALCL分子生物學提供了批判性知識,將未來的研究帶入了最有效的治療方法。”
日記
Prutsch,N.,He,S.,Berezovskaya,A.,Durbin,AD,Dharia,NV,Maher,Ka,…&Look,in(2024)。 “ PLESSIFTS STAT3激活了大細胞淋巴瘤的致癌核的轉錄調節迴路中激酶酪氨酸的信號傳導。”細胞比例的藥物,5(101472)。 doi: https://doi.org/10.1016%2fj.xcrm.2024.101472
作者周圍
達納 – 法伯癌研究所
兒科醫生
哈佛醫學院
波士頓,馬薩諸塞州。
A.托馬斯的樣子醫學博士是哈佛醫學院的兒科教授,也是達納 – 法伯癌症研究所兒科腫瘤學系的成員。 Look在密歇根大學接受了他在兒科的兒科和Pasununizer培訓中,並在兒童研究醫院在聖猶太兒童研究院接受了兒科腫瘤學培訓,在那裡他晉升了20多年,擔任田納西大學醫學學院實驗性腫瘤學和兒童學院的實驗腫瘤學系主任。他從聖兒童研究醫院轉學。 Dana-Farber癌症研究所和哈佛醫學院的猶太人於1999年專門在斑馬魚中創建研究計劃,作為人類癌症的典範。
在過去的四十年中,Look發表了390封信,通過同齡人解決了癌細胞中惡性轉化,散佈和凋亡的分子基礎,以及分子遺傳發現的應用,以改善兒童和成人惡性腫瘤的治療,尤其是急性白血病和神經蛋白細胞白血病和神經性神經細胞細胞細胞和神經細胞細胞蛋白酶肌lik蟲。
Look進行了旨在確定癌症治療新目標的遺傳研究,現在他在國際上被認為是該領域的領導者。它的小組在1994年發現了受體酪氨酸激酶(ALK)的淋巴瘤酪氨酸激酶的變性基因。這種觀點繼續表明,白血病細胞具有“必不可少的”轉錄流,這些轉錄流與那些控制許多胚胎幹細胞的人相似,這極大地改變了對子Perme Sub-Perme Special Special的感知。最近,Look及其同事表明,在TAL1癌基因的領先上游療法的區域中獲得的突變為MYB轉錄因子創造了新的結合位置。 MYB連接促進了TAL1複合物的其他成員的聯繫,並開始了TAL1癌基因上游的超級改進,指揮高水平的表達,最終達到T -all。這一發現提供了一個概念框架,用於理解改變人胸腺細胞並製定個性化療法的有效策略的遺傳事件。
此外,其實驗室開發了第一個急性T細胞淋巴細胞白血病和兒童神經細胞瘤的轉基因斑馬魚模型,為應用適用於斑馬魚模型的強大遺傳和化學技術提供了機會,以識別新的分子和分子靶標和分子靶標和分子藥物兒童。由於TET2,ASXL1和DNMT3A的喪失,他的實驗室還開發了骨髓增生綜合徵和克隆造血的最初的斑馬魚模型,他用來鑑定有選擇性靶向突變型血腫的血腫細胞和後代細胞的藥物。