胰腺導管腺癌(PDAC)在癌症領域是一個令人恐懼的對手,以其秘密進步和破壞性影響而聞名。它在全球與癌症相關的死亡的主要原因之一中排名,直到未來十年,預計將在主要原因中增長。 PDAC文字在於其侵略性,胰腺的深層解剖位置,其在晚期階段的頻繁診斷以及臭名昭著的聲譽,以減少有限的常規治療。這種艱難的情況強調了科學界的緊急行動呼籲,要求他們破譯指導PDAC無情進步的分子奧秘,為創新有效的治療干預鋪平了道路。
PDAC以其侵略性和具有挑戰性的治療景觀而聞名,很快就會在與癌症前進的戰鬥中面臨新的競爭者。奧德曼·曼恩(Outender Manne)教授及其同事在伯明翰阿拉巴馬大學(University of Alabama)與華盛頓大學的研究人員合作,德克薩斯大學里奧格蘭德大學(University of Texas Rio Grande Valley)在同齡人的修訂雜誌上發表了一項基礎研究 腫瘤。結果闡明了一個新的治療靶標,TRIV13。該蛋白在PDAC腫瘤中表達,在化學療法的腫瘤生長,轉移和耐藥性中起著重要作用。
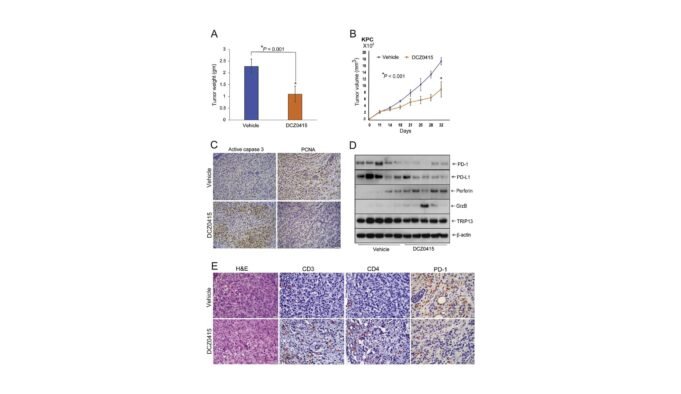
該研究的創新方法著重於使用小分子抑製劑DCZ0415的Trip13及其藥理制動的遺傳敲擊。 Manne教授和他的同事嚴格記錄了Trip13壓力對PDAC細胞,入侵,遷移和轉移的基本影響。癌症相關信號傳導的主要途徑被中斷,這標誌著PDAC治療策略的重要一步。
這項精彩研究的基礎依賴於多種多樣的方法論框架。最初,研究小組試圖了解TRIP13在PDAC中的致癌作用。他們發現Trip13充當PDAC生長和轉移的啟動子。特別是,具有DCZ0415抑製劑的Trip13靶標,無論是單獨的還是標準處理,都可以有效地禁止以高表達TRIP13為特徵的PDAC進展。
為了在PDAC細胞行為範圍內探索這種作用,該團隊僱用了各種人類PDAC細胞系,顯示了一系列遺傳起源。 “我們採購了顯示各種相互狀態的PDAC細胞系。這些細胞系在我們的全面分析中很有用,” Manne教授解釋說。
該研究的一個主要方面是通過傷口癒合測試評估PDAC細胞的遷移潛力。這種方法不僅闡明了Trip13制動對細胞遷移的影響,而且還提供了抑製劑效率的切實量度。 “對於SHRNA研究,Trip13的無聲和對照細胞以及DCZ0415治療的細胞,進行了傷口癒合分析,以確定對遷移的影響。這種方法使我們能夠在方法論學上闡述了Trip13的靶向靶向和定量。
這些發現的含義是深刻的,提供了進行生物標誌物領導的臨床測試的推理,並為改善針對PDAC的治療策略提供了希望。針對Trip13,該研究不僅為潛在的有效治療鋪平了道路,而且還為我們對這種致命疾病的分子基礎的理解做出了重大貢獻。總而言之,Manne教授及其團隊的創新研究標誌著與PDAC的鬥爭取得了重大進展。通過細緻的方法論,並關注Trip13在PDAC進步中的作用,這項研究為治療性干預開闢了新的方法,為面臨這一挑戰性診斷的患者帶來了希望。
日記
Farrukh Affoq,Sumi Agarwal,Prachi Bajpai等人,“ AAAA-ATPase Trip13致癌性還原降低了胰腺導管腺癌的進展,” Neoplasia,2024年。
doi: https://dii.org/10.1016/j.neo.2023.100951。
作者周圍
Mis。 Manne博士是伯明翰阿拉巴馬大學(UAB)的病理學,外科和流行病學教授。 He is also the director of the anatomical translation pathology section, co -director of UAB Tissue Biorepository, an old scientist of the O’Neal Comprehensive Cancer Center, an old scientist at the Nutrition and Obesity Research Center, and a senior scientist of the U. For about three decades, Prof. Manne has served as the leading investigator for series R, P and U grants initiated by investigators of the National Institute of Health/National Cancer (NCI)美國。他廣泛發表在癌症和有效性和有效性的分子生物標誌物的檢測和有效性領域,以及某些人類惡性的癌症健康不平等。他已經開發了幾種臨床前癌模型(異種移植物和從患者進行實驗性藥物測試的類器官。Manne教授學術職業的其他方面是培訓學生,醫生和科學家來進行癌症研究並具有生產性學術職業。