杏仁核側硬化症(ALS)是一種神經退行性疾病,其特徵是脊髓和大腦中運動神經元的進行性變性。 ALS患者無法自願控制,甚至無法呼吸困難。不幸的是,這種疾病無法治愈。其中一個決定隱藏在人體保護者的幾種類型的免疫細胞中。首先,科學家專注於小膠質細胞,總是警告中央居住神經系統的巨噬細胞。這些細胞在維持大腦和脊髓穩態並提供吞噬作用方面起著至關重要的作用,消除了受損的神經元或廢物。 ALS中的小膠質細胞功能不是直接的,而是相當複雜且多方面的,這給理解科學家帶來了重要的挑戰。活化的小膠質細胞是高度異構細胞,具有許多遺傳來源的調節子元素以及所有其他相關基因,它們都可以與感興趣的基因相互作用。然而,遺傳背景對特定形式的小膠質細胞的正確作用及其與其他形式的免疫細胞的相互作用在ALS中的病理機制方向上的影響尚不清楚。
研究背景對微膠質的異質性的遺傳變異的影響以及ALS小鼠模型中的功能是由Okiru Komine博士和Koji Yamanaka教授領導的,來自Neuroscience and病原體學系的Koji Yamanaka教授,與醫學環境研究所(RIEM),Nagoya大學,他們的團隊。該團隊包括遺傳學系,RIEM,Naogya大學的Tomoo Ogi教授和Naogya大學研究生院免疫學系的Kunihiko Hinohara副教授,已做出了相當大的努力來理解ALS的病理性質。他們的集體努力強調了合作在促進神經退行性疾病知識方面的重要性。
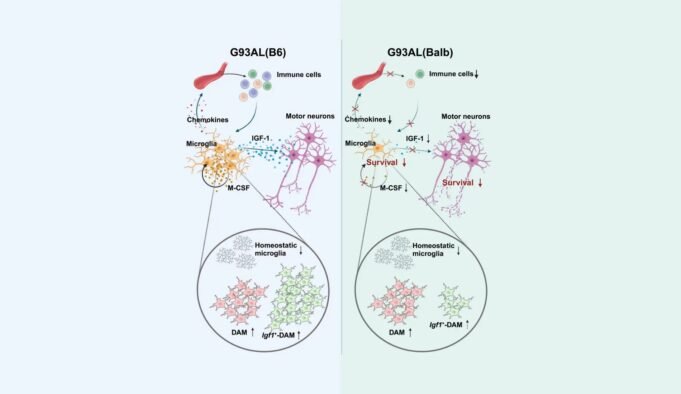
這本發表在Iscience上的最初文章是第一個揭示了特殊ALS模型的兩隻小鼠的小膠質細胞異質性的遺傳變化對遺傳變化的深遠影響。通過細緻的方法進行的研究,例如行為,分子,細胞生物學和遺傳技術,包括對單細胞RNA序列的分析,已經揭示了遺傳多樣性對ALS小膠質細胞不足的影響。對單細胞RNA序列的詳細分析已檢測到十二組基因表達中的小膠質細胞異質性,從而顯著促進了我們對ALS病理學的理解。
Koji Yamanaka教授解釋說:“在ALS研究中使用的特殊酶編碼基因增生酶1中具有突變的小鼠模型不僅是研究小膠質細胞的異質性,而且還研究T-淋巴細胞的影響以及其他炎症細胞和影響和影響的免疫疾病和影響的影響和影響的影響和影響的影響。浸潤。
研究進一步宣布滲透性免疫細胞數量的變化以及在疾病的最後階段,黑鼠模型和白化病之間的外周免疫細胞的比率。一些大壩標記表現出黑色大鼠和白化病之間的小膠質細胞之間的反向調節。 Okiru Komine博士說:“基於我們當前和以前的研究,我們建議來自外周免疫細胞和/或浸潤性免疫細胞的環境因素可以通過調節大壩大鼠的存活和誘導來影響疾病的進展。”總之,Okiru Komine博士,Koji Yamanaka教授及其高素質的團隊進行了廣泛的研究,揭示了改變小膠質細胞異質性的遺傳背景的重大影響,其反應和ALS模型小鼠中疾病的進展。但是,由於實驗僅限於兩種菌株,因此團隊強調了包括不同遺傳起源的ALS小鼠的進一步分析的必要性。這對於全面理解基本機制並為可能的治療打開道路至關重要。
日記
Okiru Komine,Syuhei Ohnuma,Kunihiko Hinohara,Yuichiro Hara,Mayuko Shimada,Tomohiro Akashi,Seiji Watanabe,Akira Sobue,Noe Kawade,Tomoo Ogi,Tomoo Ogi和Koji Yamanaka。 “背景的遺傳變化會影響小膠質細胞的異質性和疾病的進展,以杏仁性側向硬化症的模式。” Iscence 27(2024)108872。
doi: https://doi.org/10.1016/j.isci.2024.108872。
作者周圍
Okiru Komine博士 他是日本納戈亞納戈亞大學環境醫學研究所神經科學與豆豆生物學系的講師。 Komine博士獲得了學士學位和碩士學位他於2001年和2003年獲得東京科學大學。他獲得博士學位。從2007年的東京醫學和牙科大學出發。其主要研究領域是神經炎症性疾病的神經炎症,例如肌萎縮症狀硬化和阿爾茨海默氏病。最近,它還集中在免疫系統在這些疾病中的作用。他喜歡打網球。